化学の濃度の定義と計算の方法の解説です。
溶質と溶媒
なんらかの物質が液体に溶けているとき、これを溶液といいます。また、溶けている物質を溶質・溶かしている物体を溶媒といいます。
身の回りにある溶液はほとんどの場合水が溶媒になっています。そのため水が溶媒になっている溶液を特に水溶液といいます。
例)
塩酸は塩化水素が水に溶けた水溶液です。
溶質は塩化水素・溶媒は水です。
高校化学の範囲では、有機化合物の単元で有機物質が溶媒として登場することがあります。
濃度
溶液にどのくらいの溶質が溶けているかを表す指標を濃度といいます。
濃度はどのように基準をとるかによってさまざまに種類があり、状況に応じて使いやすい濃度を選んで使います。
この記事では高校化学で利用される質量パーセント濃度、体積モル濃度、質量モル濃度を紹介します。
質量パーセント濃度
溶液中に含まれる質量の割合をパーセントで表したものです。
溶媒100gあたりに溶媒が何g含まれるかを表します。
ほかの表し方に比べて直感的にわかりやすく、定義上溶液以外にも適用しやすいという利点があります。
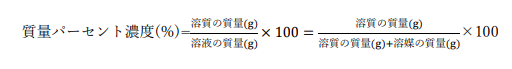
質量パーセント濃度計算の例
例題

解答
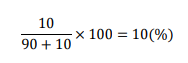
モル濃度
溶液1Lあたりに溶質が何mol含まれているかを表したものです。
体積あたりに溶質が何個(何mol)含まれているかがわかるので、溶質が溶液内で化学反応する場合に使用すると便利です。
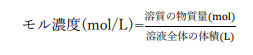
モル濃度の計算の例
例題

解答

質量モル濃度
溶媒1kgあたりに溶質が何mol含まれているかを表したものです。
化学基礎の範囲では登場しませんが化学の範囲では溶液の沸点上昇・凝固点降下・浸透圧を考えるときに必要になります。
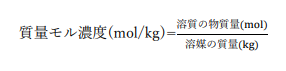
質量モル濃度の計算例
例題

解答

練習問題



コメント