化学の放射性同位体と放射線に関する解説記事です。
同位体
陽子数(原子番号)が同じで中性子数が異なる(質量数が異なる)原子の組を同位体といいます。
放射性同位体(ラジオアイソトープ)
原子の中には原子核が不安定なものが存在します。
原子核の不安定な原子は原子核が崩壊してしまうことがあり、このとき放射線を放出します。
このように原子核が崩壊し放射線を放出する原子を放射性同位体、または英語でラジオアイソトープ(Radio Isotope)といいます。
崩壊の種類
崩壊の種類としてはα崩壊、β崩壊、γ崩壊をおさえておきましょう。
α崩壊
原子核が崩壊して![]() を放出する崩壊をα崩壊といいます。
を放出する崩壊をα崩壊といいます。
またこのとき放出される放射線(![]() そのもの)をα線といいます。
そのもの)をα線といいます。
α崩壊では![]() を放出しているので崩壊前に対して原子番号が2、質量数が4減少します。
を放出しているので崩壊前に対して原子番号が2、質量数が4減少します。
例)
![]() がα崩壊すると、原子番号が2小さいRnになります。
がα崩壊すると、原子番号が2小さいRnになります。
このとき、質量数は4へって、![]() になります。
になります。
β崩壊
安定状態に対して陽子数が相対的に少ない原子核については中性子が陽子に変化することで陽子数を増やし安定になろうとします。
中性子が陽子になるとき正の電荷があふれる分負の電荷(=電子)を放出します。
このように中性子が陽子になって電子を放出する一連の崩壊をβ崩壊といい、このとき放出される電子線をβ線といいます。
β崩壊では中性子が陽子に変化するので原子番号は1増えますが、質量数は変化しません。
例)
![]() はβ崩壊し、原子番号の1大きいSになります。このとき質量数は変化しないので、
はβ崩壊し、原子番号の1大きいSになります。このとき質量数は変化しないので、![]() となります。
となります。
γ崩壊
α崩壊やβ崩壊すると、原子核が不安定になることがあります。
このときに安定になるためエネルギーを放出します。
これをγ線といいます。
単にエネルギーを放出するだけなので質量数、原子番号ともに変化しません。
半減期
放射性同位体は確率的に崩壊しますが、通常考える範囲ではmol単位でたくさんあるので一定時間ごとに一定割合で減少していくとみなすことができます。
放射性同位元素の割合が半分になるまでの時間を半減期といいます。
例)![]() の半減期は5730年です。
の半減期は5730年です。
ある黒鉛の固体において![]() の含まれる割合はちょうど5730年後には半分に、5730×2=11460年後には1/4になります。
の含まれる割合はちょうど5730年後には半分に、5730×2=11460年後には1/4になります。
また高校範囲は逸脱しますが、半減期T年の放射性元素の現在の物質量をN0[mol]とするとt年後の物質量を
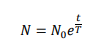
と表すことができます。
炭素同位体による年代測定
炭素の中にごく微量含まれている14Cは、動植物内においても常に一定割合で存在しています。
これは体内に取り込まれた14Cが崩壊によって減少していく一方で、光合成や食事によって常に新たな14Cが供給され続けているからです。
ところが、動植物の死後は14Cが供給されなくなるので減っていく一方です。
そこで14Cの割合は半減に従って減少していきます。
そこで14Cの割合を測定することで対象物がおおよそ何年前のものか推定することができます。
これを炭素同位体法といいます。
練習問題1

練習問題1の解答
題意から崩壊前のAmは原子番号は95、質量数が241とわかります。
α崩壊後は原子番号は2減少し、質量数は4減少するので、崩壊後は
原子番号は95-2=93
質量数は241-4=237
となります。
練習問題2

練習問題2の解答
存在比が1/16になっていることから、半減期が4回訪れていることがわかります。
よって経過時間は半減期の4倍で、
5730×4=28650年


コメント