収率の定義
高校化学の世界では特に断りがなければ、ある化学反応が起これば全てが目的生成物に変化します。
しかし実際の化学反応では全てが目的の生成物に変化するとは限りません。
他の反応(副反応)が起きるかもしれないし、そもそも反応しない原料もあります。
そこで、理論上得られるはずの目的物質に対してどれくらい目的物質を得られたかという指標が必要になります。
これを収率といい、以下の式で定義します。

この収率という概念、教科書にはのっていないにもかかわらず、入試問題の特に有機化合物の分野で結構出題されます。
理由は主に三つあって、
- 有機化合物の研究上重要である
収率が低いと目的物質を手にいれる効率が悪くなるので、収率をあげるというのは有機化合物の研究上重要命題です。
問題を作る教授たちもよく触れていますから、出題したくなるわけです。
- それほど複雑でない
教科書にのってないわりに、やっていることは単なる物質量計算と割り算だけ。
概念も計算もそれほど複雑でないので思考力をためす問題としてちょうどよく出題しやすい。
- 問題の流れに組み込みやすい
連動問題のなかで、最初に有機化合物の知識をきいて、反応の経路について答えてもらい、最後にそれらを総合して収率を計算させる、という流れが自然で大問の最後に出題しやすい。
そういうわけで化学を受験科目に考えているなら一度は収率に関する問題に触れておくべきです。
例題

単に収率を問うだけだと与えられた定義式に代入して割り算をするだけになるので、たいてい有機化合物の反応の知識と絡めての出題になります。
この例題だとアニリンと無水酢酸の反応の知識を絡めての出題になっています。
例題の解答
まず問われている反応の反応式をかいて、理論上得られる目的物質(アセトアニリド)の物質量を計算します。
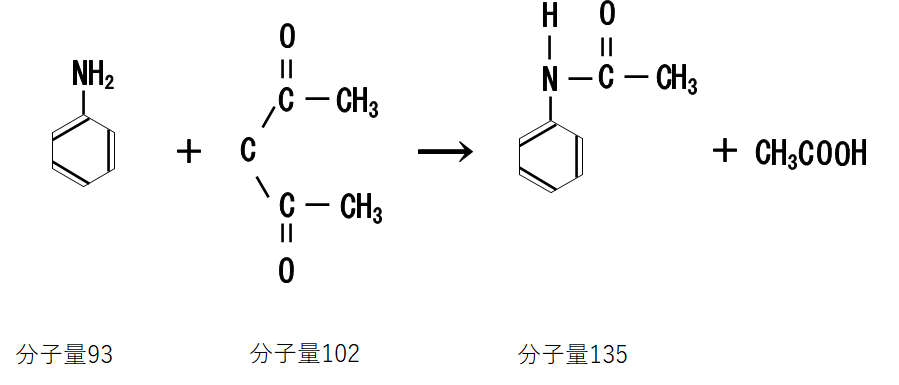
各物質の物質量は、
アニリン:0.93g÷93=0.01mol
無水酢酸:1.02÷102=0.01mol
でアニリンと無水酢酸は1:1で反応し1のアセトアニリドが生成するので、
理論上得られるアセトアニリドの物質量は0.01molで、その物質量は
0.01mol×135=1.35g
です。
よって収率の定義にあてはめて収率は
(1.00g÷1.35g)×100=74%
となります。
練習問題



コメント