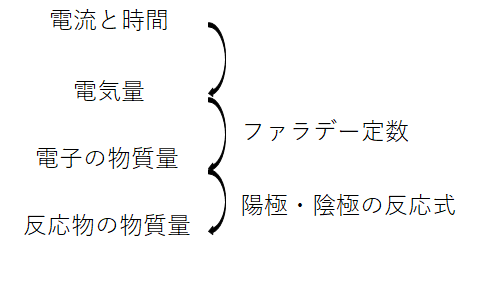
電気量
電荷の単位はクーロンCといいます。
電流の流れの正体は電子の流れなので、電荷の単位クーロンは電流の流れと関連づけることができます。
1Aの電流が1秒間流れたとき、移動した電気量を1C と定義します。
例
2.0Aの電流を60秒間流したとき、移動した電気量は
2.0×60=120C
です。
電極での化学反応と電気量の関係
電流の流れは電子の流れなので、電気量と電極で反応する物質量を関連づけることができます。
ファラデー定数
1molの電子がもつ電気量を表す定数をファラデー定数といい、Fで表します。
ファラデー定数FはF=96500C/mol
このファラデー定数により、流れた電気量と反応した電子の物質量を関連づけることができます。
例題
0.02Aの電流を80分25秒間流したとき、
(1)流れた電気量は何Cか。
(2)流れた電子の物質量は何molか。
解答
(1) 80分25秒は4825秒なので、
流れた電気量は
0.02×4825=96.5C
(2) 流れた電子の物質量は
96.5C÷96500C/mol=1.0×10-3mol
電気量と電気分解で反応する物質量の関連付け
このようにファラデー定数により電気量と流れた電子の物質量が関連付けられますので、
陽極・陰極での電子を含んだ半反応式の量的な関係を考慮すれば、陽極・陰極で発生・消費される物質の量を計算することができます。
例題

解答の方針
電流と時間が与えられているので電気量から流れた電子の物質量がわかります。
陽極・陰極それぞれでの半反応式を書いて係数を比較することで発生した物質の物質量が計算できます。
例題の解答
流れた電気量は、
2.5A×386秒=965C
よって流れた電子の物質量は
965C÷96500C/mol=0.01mol
ここで陽極・陰極での反応式は、
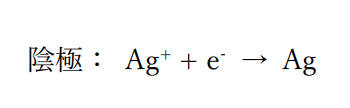
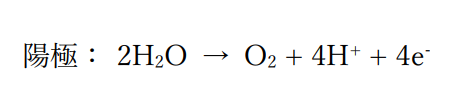
反応式の係数から電子の物質量に対して発生する銀・酸素の物質量は、
銀が1,酸素が1/4なので、
陰極で析出した銀の質量は
0.01mol×1×108=10.8g
陽極で発生した酸素の標準状態での体積は
0.01mol×(1/4)×22.4L/mol=0.056L
練習問題



コメント