この記事では水素の原子半径を計算によって予測してみましょう。
計算には高校物理レベルの知識が必要です。
少し応用的な部分があるので、入試でも出題されるかもしれません。(少なからず出題歴もあります。)
計算の仮定
計算を簡単にするために仮定をおきます。
中性子のない水素原子1Hについて、陽子一つの周りを一つの電子が速度Vで等速円運動していると仮定します。
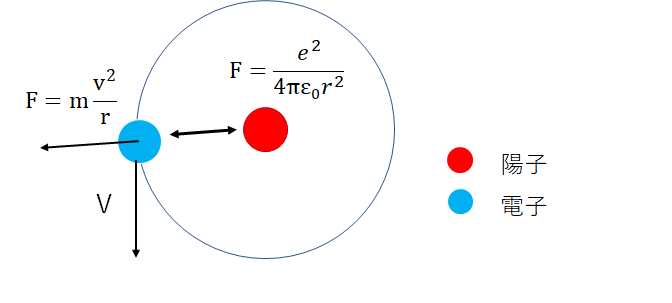
陽子と電子はともに電荷を帯びていて、その電荷はeです。
陽子と電子の距離(=水素原子の半径)をrとすると、
陽子と電子にはクーロン力が働き、遠心力と釣り合っているので
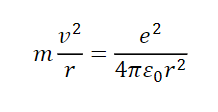
ボーアの量子条件
この項目は高校物理の教科書にはのっていませんし、理屈を説明すると高校範囲から大きく逸脱するので
結果のみを示します。(理系の学部に進学すれば大学1年生で詳しく学習します。)

n=1,2,3・・・がそれぞれK殻,L殻,M殻・・・に対応します。
代入しよう
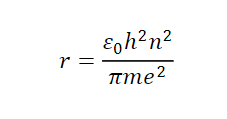
ここで各定数は
真空の誘電率ε0=8.85×10-12
プランク定数h=6.63×10-34
円周率π=3.14
電子の質量m=9.11×10-31kg
電子と陽子の電荷e=1.60×10-19C
を代入すると、
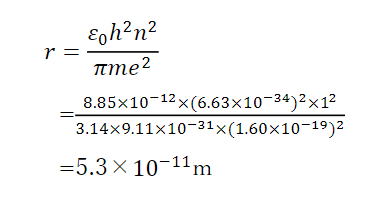
実際の水素原子の半径
実際の水素原子の原子半径はさらに精密な測定で
5.29×10–11mとされています。
計算値との誤差は0.3%程度なので、かなり正確に計算できていることがわかります。
水素以外の場合は?
水素の原子半径は精度よく計算できましたが、ほかの原子では高校レベルはもとよりコンピューターシミュレーションでも難しいことが知られています。
たとえば原子量が1ふえたヘリウム原子では陽子2つ、電子2つになりますが、
・陽子Aと陽子Bの相互作用
・陽子Aと電子Aの相互作用
・陽子Aと電子Bの相互作用
・陽子Bと電子Aの相互作用
・陽子Bと電子Bの相互作用
・電子Aと電子Bの相互作用
の6種類の相互作用の考慮する必要があり、1つの相互作用だけを考えればよかった水素原子に比べて計算量が大幅に増加しています。
ヘリウムでもこうなので、さらに陽子・電子が増えるとスーパーコンピューターで計算しないととても計算できたものではありません。


コメント