反応を利用して電気エネルギーを取り出す装置を電池といいましたが、
この逆に電気エネルギーを利用して化学反応を起こす方法を電気分解と言います。
電池で正極に対応する極を電気分解では陽極、電池で負極に対応する極を電気分解では陰極といいます。
電池では電流は負極から正極へ流れ、電子は電流とは逆に正極から負極に流れました。
電気分解では電池とは逆に電流を陰極から陽極に流し、電子は陽極から陰極に流れます。
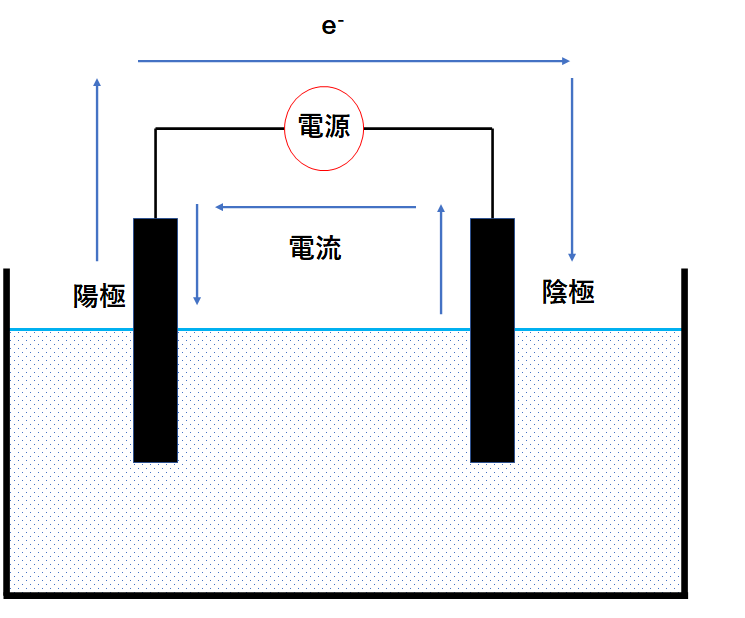
陽極では物質が電子を奪われて酸化され、
陰極では物質が電子を受け取って還元されます。
電気分解のルール
陽極、陰極で酸化・還元される物質は溶液内の物質の種類と電極の種類によってきまり、物質それぞれの酸化・還元のされやすさに基づきます。
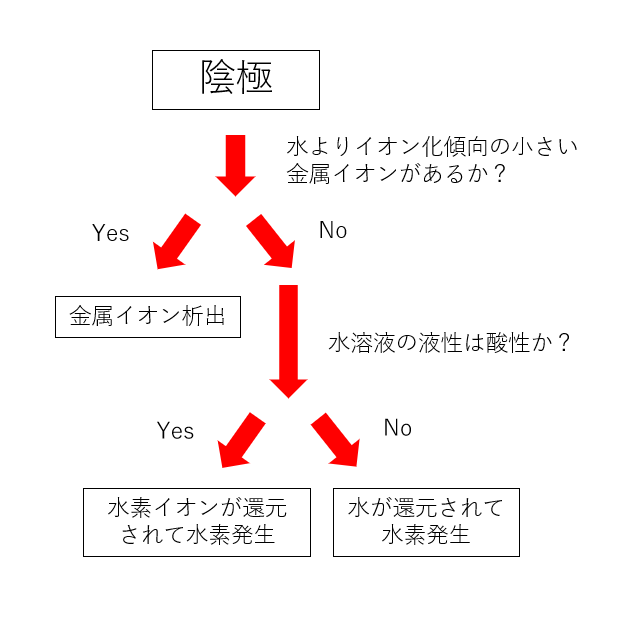
陰極での反応のルール
陰極では物質が電子を受け取って還元されます。
水よりもイオン化傾向の小さい金属の陽イオンが含まれる場合
水よりもイオン化傾向の小さい(還元されやすい)金属の陽イオン(銅や銀など)が含まれている場合、金属の陽イオンが電子を受け取って金属の単体として電極上に析出(固体として現れてくること)します。
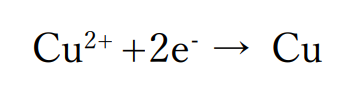
水よりもイオン化傾向の小さい金属が含まれない場合
水が最も還元されやすい物質になるので、水が還元されます。
このとき、水素が発生します。
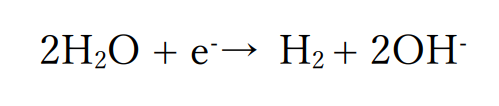
水よりもイオン化傾向の小さい金属が含まれない酸性水溶液の場合
水溶液が酸性でかつ水よりもイオン化傾向の小さい金属が含まれない場合、酸性ゆえに大量に存在する水素イオンが還元されて水素が発生します。
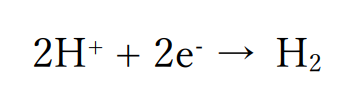
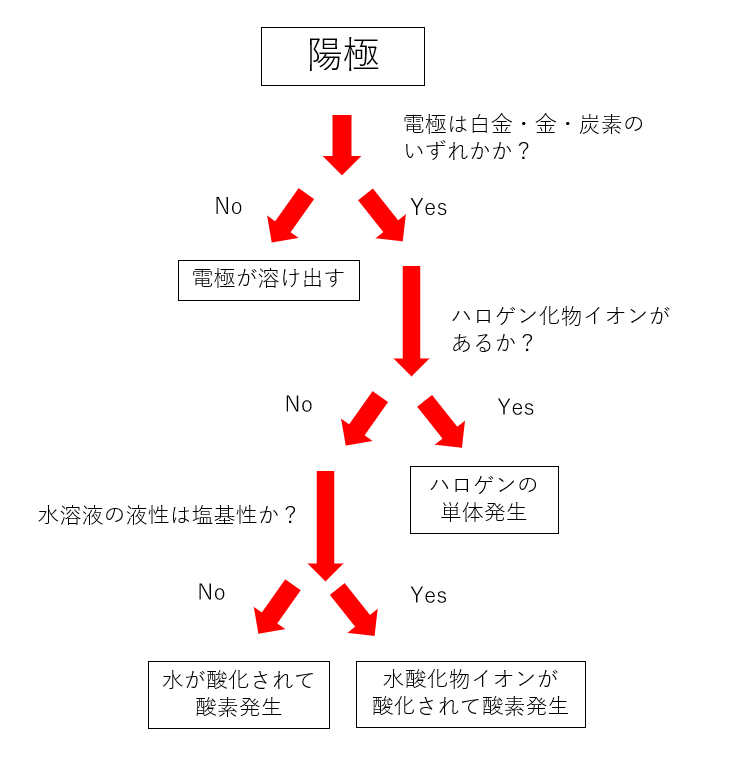
陽極での反応のルール
陽極では物質が電子を奪われて酸化されます。
電極を構成する物質が電子を奪われることで陽イオンとなり溶け出すこともあります。
陽極板が金、白金、炭素以外のとき
陽極が金、白金、炭素以外のときは陽極板から電子が奪われて陽イオンとなり溶け出します。
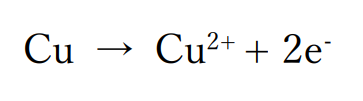
陽極板が金、白金、炭素の場合
陽極板が金、白金、炭素以外の場合は、これらの物質は陽イオンになりにくいので溶け出さず代わりに水溶液中の物質から電子を奪うことになります。
ハロゲン化物イオンが含まれる場合
水溶液にハロゲン化物イオンが含まれる場合、ハロゲン化物イオンが酸化されてハロゲンの単体が生成、気体となります。
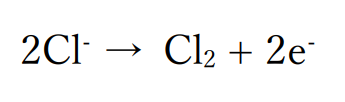
ハロゲン化物イオンが含まれていない場合
ハロゲン化物イオンが含まれていない場合は、水分子が酸化されて酸素が発生します。
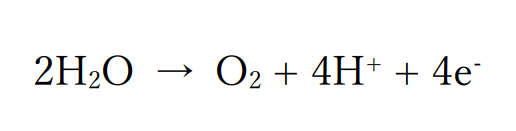
ただし、水溶液が塩基性である場合は大量に存在する水酸化物イオンが酸化されて酸素が発生します。
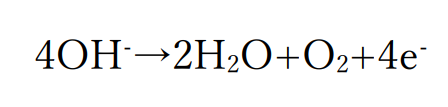
電気分解のフローチャート
電気分解の例
塩化ナトリウム水溶液の電気分解
陽極・陰極ともに白金電極を用いて塩化ナトリウム水溶液を電気分解した場合、
陰極では水よりもイオン化傾向の小さい金属は含まれない(ナトリウムは水よりもイオン化傾向が大きい)ので水素が発生します。
塩化ナトリウムの水溶液は中性なので、水が還元されて水素が発生します。
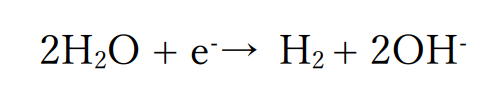
陽極では白金電極を用いているので、電極が溶け出すことはありません。
しかし塩化物イオンが含まれているので塩化物イオンが酸化されて塩素の単体が生じます。

硫酸銅水溶液の電気分解
陽極・負極ともに白金電極を用いて硫酸銅水溶液を電気分解した場合、
陰極では水よりイオン化傾向の大きい銅(Ⅱ)イオンが含まれているので、この銅(Ⅱ)イオンが還元されて陽極上に銅の単体が析出します。
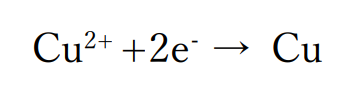
陽極では白金電極を用いているので、電極が溶け出すことはありません。
またハロゲン化物イオンが含まれているわけでもないので、結局酸素が発生することになります。
硫酸銅水溶液は強塩基性ではないので、水が酸化されて酸素が発生することになります。
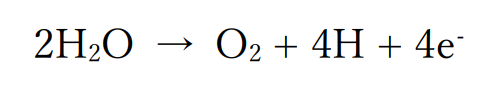
【関連記事】


コメント