原子量・分子量・式量について解説します。
原子量・分子量・式量は化学基礎の基礎事項でひいては化学全体でも基礎になる最重要事項です。
相対質量
原子の質量は非常に小さいので、gであらわすと不都合です。
そこで質量数12の炭素の質量を12として、他の原子の質量を決めることにしています。
このようにして決めた質量を相対質量といいます。
質量数の数値と相対質量の数値はおおむね(実用上の範囲で)一致します。
例:16Oの相対質量は16です。
原子量
原子には同位体が存在し同位体どうしは中性子数が異なる故に相対質量も異なります。
しかし基本的に同位体の割合は一定なので、マクロにみればある同じ相対質量の原子が100%存在していると見なすことができます。
このように同じ相対質量の原子が100%存在しているとしたときの原子の原子量相対質量を原子量といいます。
例:塩素原子は
35Clと37Clの2種類の同位体がそれぞれ75%,25%存在していることが知られています。
原子量は平均を考えて
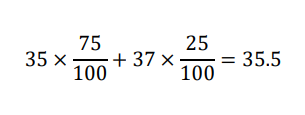
分子量
分子1つの12Cに対する相対質量を分子量といいます。
分子量は、その分子を構成する原子の原子量の和で表すことができます。
例:二酸化炭素CO2の分子量は 炭素の原子量が12,酸素の原子量が16なので、
12+16+16= 44です。
式量
イオン結合からなる物質は、分子のように1分子というものが決められないので分子量という値は使えません。そこでかわりに式量という値を使います。
式量はその物質の組成式を構成するすべての元素の原子量の和で表すことができます。
例:塩化ナトリウムの式量
塩化ナトリウムの化学式はNaClです。
ナトリウムの原子量が23,塩素の原子量が35.5なので、式量は
23+35.5=58.5
練習問題1

練習問題1の略解
10.8
練習問題2
以下の物質について分子量または式量の適切なものをもとめよ
炭素の原子量を12,フッ素の原子量を19,カルシウムの原子量を40とする。
(1) メタンCH4
(2) フッ化カルシウムCaF2
練習問題2の略解
(1) 12+1×4=16
(2) 40+19×2=78


コメント