混合物の分離法のひとつである再結晶の原理と計算問題について解説します。
再結晶の計算問題は特に化学基礎で頻出の内容です。
再結晶とは
再結晶は物質の溶媒への溶けやすさの違いを利用して混合物から純粋な物質を取り出す操作です。
常温常圧で固体である物質のほとんどは溶媒の温度が上がると溶ける質量が増えるので、この溶ける質量の差を利用して純粋な物質を得ます。
溶解度と溶解度曲線
ある物質が、ある温度のある溶媒にどれくらい溶けるかを表す数値を溶解度といいます。
主に溶媒100gに何gの溶質が溶けるかであらわします。
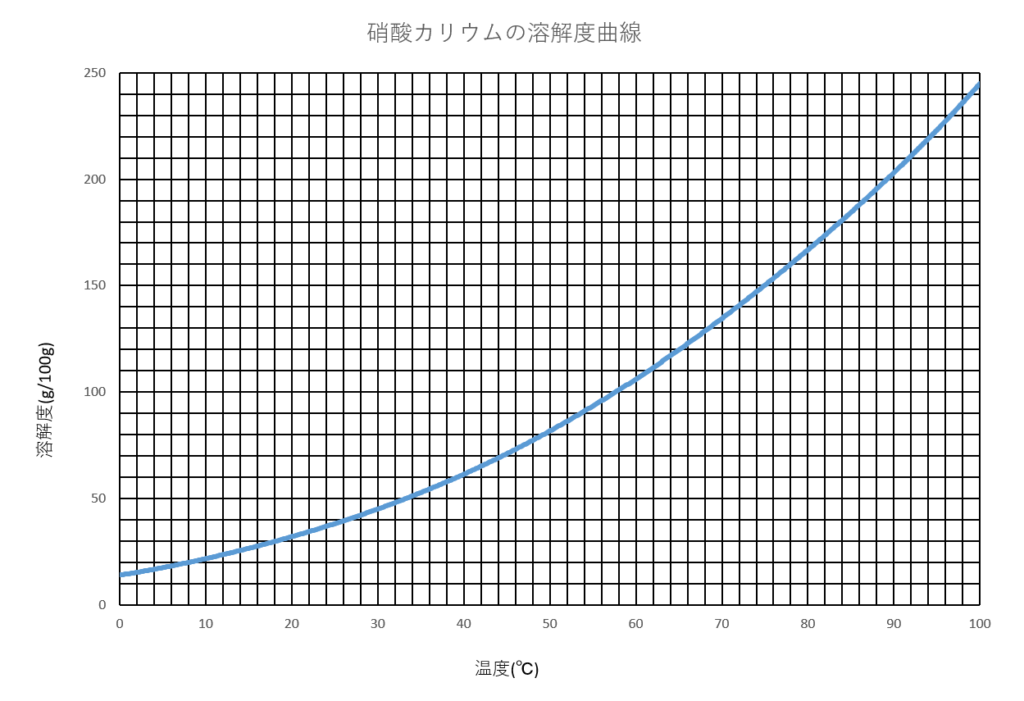
横軸に溶媒の温度を、縦軸に溶解度をとったグラフを溶解度曲線といいます。
再結晶の原理
固体の混合物を温度の高い溶媒に溶かし、飽和水溶液にしたものの温度をゆっくりと下げていきます。
温度を下げると固体の溶解度は下がり、溶けられなくなった分が析出(固体となって現れる)してきます。
温度の変化に対して溶解度の変化の大きい物質は固体として析出しやすく、
逆に温度の変化に対して溶解度の変化の小さい物質はあまり析出してきません。
混合物に対して都合のよい溶媒を選ぶことで目的の物質だけが析出してそれ以外の物質は析出しないようにして目的物質を分離できます。
例えば、硝酸カリウムと塩化ナトリウムの混合物から硝酸カリウムだけを得たいとき、
硝酸カリウムは温度が変化すると溶解度が大きくかわり、塩化ナトリウムは温度が変化しても溶解度があまり変わらない水を溶媒に選ぶと硝酸カリウムだけを取り出すことができます。
例題

例題の解答
58℃から18℃に冷却したときに、それだけの硝酸カリウムが溶けきれずに析出するかを考えます。
グラフから読み取ると、58℃での硝酸カリウムの溶解度は100g
つまり、100gの水に100gの硝酸カリウムが含まれているので、
200gの水溶液中に100gの硝酸カリウムが含まれているとわかります。
比を考えると、400gの飽和水溶液中の硝酸カリウムは200g含まれています。
一方で400gの飽和水溶液中の水は200gです。
次に18℃で200gの水に何gの硝酸カリウムが溶けることができるかを考えます。
グラフから読み取ると、18℃で100gの水に硝酸カリウムは30g溶けることがわかります。
すなわち200gなら30g×2=60g溶けますね。
ところが、58℃の水には200gの硝酸カリウムが含まれていました。
18℃にすると60gしか溶けないので200g-60g=140gは溶けることができずに析出することになります。
析出量は140gです。
練習問題

練習問題の略解
18g


コメント