金属の溶液中での陽イオンへのなりやすさをイオン化傾向といいます。
陽イオンになるということは電子を放出するということなので、
イオン化傾向が大きいということはその原子は酸化されやすいということもできます。
金属のイオン化傾向
このイオン化傾向の大きい順に並べたものをイオン化列といい、一般的な金属についてまとめると以下のようになります。
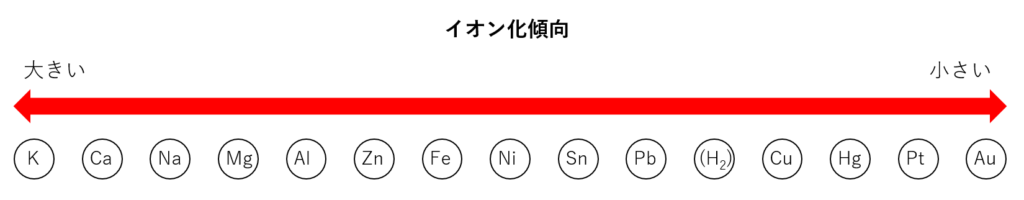
(水素分子は比較用)
金属のイオン化傾向はおおまかにはその原子のイオン化エネルギーの大小に関係しそうです。
ただし金属ごとに安定になるイオンの価数が異なるため、
完全にイオン化エネルギーが小さい=イオン化傾向が大きいということにはなりません。
金属の反応のしやすさ
イオン化傾向の大小は水やほかの金属との反応のしやすさにかかわります。
イオン化傾向の大きい金属は陽イオンになりやすいので酸化されやすく、還元力が強いといます。
逆に、イオン化傾向の小さい金属の陽イオンは電子を受け取って金属原子に戻りやすいので、還元されやすく酸化力が強いといえます。
たとえばナトリウムは常温で速やかに酸化され、冷水と反応して水酸化物となり水素を発生します。
2Na +O2 → Na2O
2Na +2H2O → 2NaOH + H2↑
金属と空気・水・酸との反応
各金属と空気・水・酸との反応をまとめた表を示します。
イオン化傾向が大きいほど反応性が高くなることがわかります。
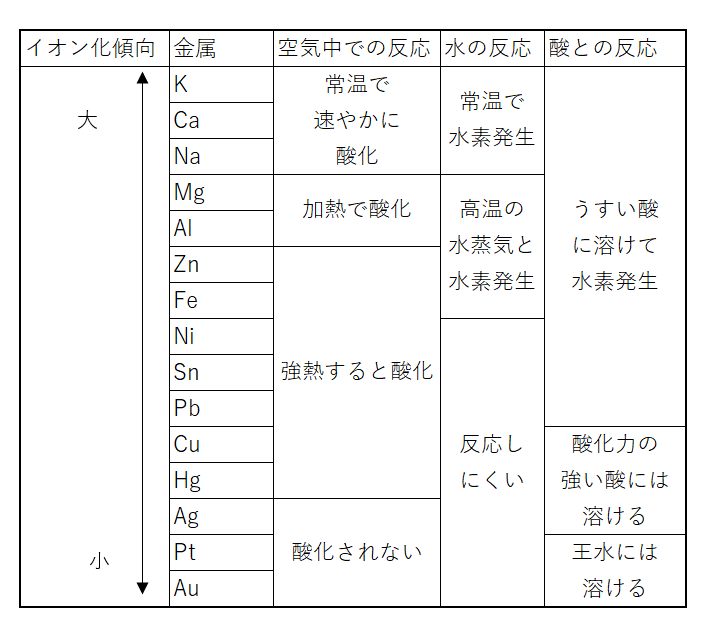
※鉛は希塩酸や希硫酸には、酸化被膜を形成するため溶けにくい
※王水は濃硫酸と濃塩酸を体積比で1:3で混合した液体
練習問題
(1)マグネシウムを強熱したときの化学反応式を書け
(2)カルシウムと高温水蒸気と反応させたときの化学反応式を書け
(3)亜鉛を希塩酸と混合したときの化学反応式を書け


コメント