有機化合物の元素分析実験と実験結果から有機化合物の示性式を求める方法を解説します。
有機化合物の元素分析実験
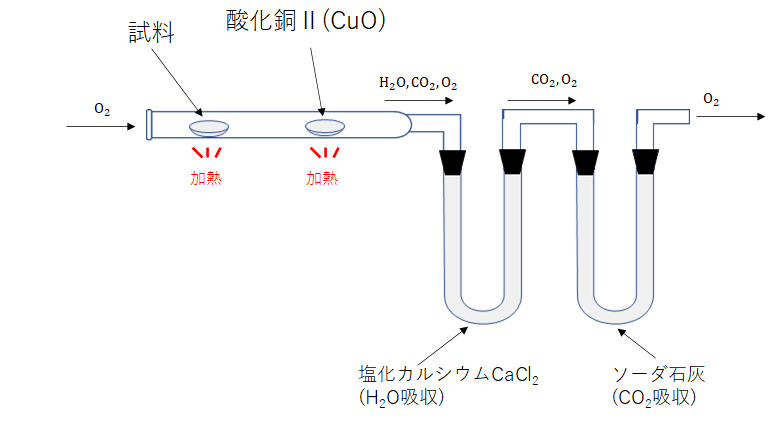
この実験装置はおおまかに、
- 試料を燃焼させる部分
- 酸化銅(Ⅱ)で試料を完全酸化させる部分
- 発生した二酸化炭素と水を吸収して質量を調べる部分
に分けられます。
試料を燃焼させる部分
酸素・炭素・水素からできた有機化合物は完全燃焼させると二酸化炭素と水だけが生成します。
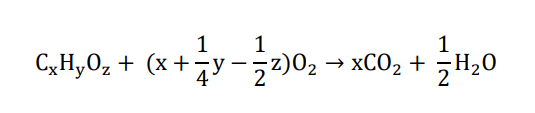
このため、得られた二酸化炭素と水の質量から目的の有機化合物の示性式を求めることができます。
有機化合物を完全燃焼させるために酸素を通しながら加熱し酸化させていきます。
酸化銅(Ⅱ)で完全酸化させる部分
有機化合物は不完全燃焼して一酸化炭素を生じやすく、このままでは正しく示性式を求めることができません。
不完全燃焼で発生した一酸化炭素を完全に酸化して二酸化炭素にするために、吸収部分に通す前に酸化銅(Ⅱ)に触れさせて完全に酸化します。
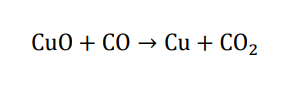
発生した二酸化炭素と水を吸収して質量を調べる部分
このように完全に酸化して得られるのは二酸化炭素と水の混合物なので、このままでは計算に使えません。
そこで二種類の吸収剤を通すことで適切に分離して質量を別々に測定します。
1.乾燥剤である塩化カルシウムを詰めた試験に管混合物を通して、水を吸収させます。
この試験管の質量増加を調べることで発生した水の質量を計算できます。
2.次にソーダ石灰管に通して残った二酸化炭素を吸収させます。
なおこの塩化カルシウム管とソーダ石灰管は順序を入れ替えることはできません。
ソーダ石灰は二酸化炭素と水の両方を吸収するので逆にしてしまうとうまく分離できないからです。
実験結果から実験式を決める方針
実験結果(二酸化炭素と水の生成量)から有機化合物内の炭素、水素、酸素の物質量比(示性式)を求めることができます。
発生した二酸化炭素の質量から有機化合物内の炭素の質量を求める
有機化合物内の炭素は完全燃焼ですべて二酸化炭素になるので、二酸化炭素内の炭素の質量が有機化合物内の炭素の質量と等しくなり、

発生した水の質量から有機化合物内の水素の質量を求める
有機化合物内の水素は完全燃焼ですべて水になるので、水内の水素の質量が有機化合物内の水素の質量と等しくなり、

酸素の質量を求める
有機化合物は炭素、水素、酸素だけからなるとしているので、有機化合物内の酸素の質量は有機化合物全体の質量から炭素の質量と水素の質量を除いたものに等しく、

質量から炭素・水素・酸素の物質量比を求める
有機化合物を構成する炭素・水素・酸素の質量がわかりました。
分子量で割ることでそれぞれの元素の有機化合物内の物質量がわかります。
それらの比をとれば、物質量比がわかります(=示性式がわかります)
示性式をCxHyOzとすると、

すなわち、

分子式を求める
示性式を求めることができましたが、ここでわかったのはあくまで有機化合物内の炭素・水素・炭素の比に過ぎません。
たとえば、示性式がCHとわかったとして、C2H2なのか、C6H6なのか、これだけでは決められないということです。
分子式を確定させるには別に実験を行って分子量を決定する必要があります。
分子量を決定する手段としては
- 気体の質量を測定する
- 希薄溶液の凝固点降下度を測定する
- 浸透圧を測定する
といった手段があります。
窒素や硫黄が含まれる場合
有機化合物内に窒素や硫黄など炭素・水素・炭素以外の元素が含まれる場合はこのような実験では決定できません。
窒素や硫黄を燃焼させる場合は複数の酸化物が発生するため、うまく計算できないからです。
入試ではこのような場合は質量パーセントを与えて計算させることが多いです。
例題

例題の解答
有機化合物内の炭素・水素の質量は
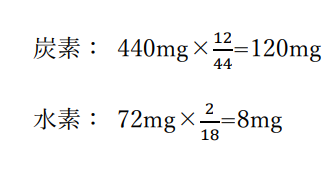
よって有機化合物内の炭素・水素の物質量の比はこの有機化合物の示性式をCxHyとすると
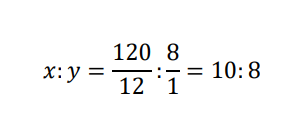
よってこの有機化合物の分子式はnを用いて
(C10H8)nと表される。
分子式が128なので、n=1
よって分子式は
C10H8
練習問題

練習問題の略解
C2H6O2


コメント